2型糖尿病では健常者に比較して約3倍の心血管疾患リスクがあり、大腿骨々折リスクも約1.7倍に増加していることが明らかとなっています。
一方で、2型糖尿病患者では骨密度の低下はなく、正常あるいは上昇しているとも報告されています。
なぜ骨密度の低下がないにも関わらず骨折リスクが増加しているのでしょうか?
骨は石灰化基質とコラーゲン架橋により適度なしなやかさを保ち、骨の強度を維持しています。また、骨は骨芽細胞と破骨細胞によるリモデリングが常時繰り返されており、常に新しい骨組織が形成されています。
2型糖尿病では悪玉コラーゲン架橋(AGE架橋)の形成が増加していること、皮質骨での多孔性が存在すること、また骨芽細胞機能の低下を伴う骨リモデリングの低下などが2型糖尿病における骨脆弱性の原因である可能性が報告されています。
2型糖尿病における骨芽細胞成熟度障害の存在
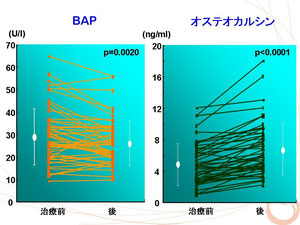
そこで我々は2型糖尿病治療経過における骨代謝マーカーの変化を検討しました。
血糖コントロール不良の2型糖尿病患者(平均HbA1c 10%)を約1ヶ月間治療し(HbA1c 8.8%へ減少)、その前後における骨代謝マーカーの変化を検討しました。
臨床において骨型アルカリホスファターゼ(BAP)、オステオカルシンはともに骨形成マーカーとして使用されています。しかしながら、我々の検討ではBAPは治療後には有意に低下したのに対して、オステオカルシンは有意に上昇しました。
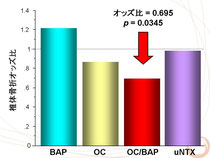
骨芽細胞は分化の初期にはBAPを分泌し、後期になってからオステオカルシンを分泌することからBAPとオステオカルシンの比率は骨芽細胞の分化度合いの指標になると考えられます。
以前の培養骨芽細胞を用いた検討において、高血糖状態ではアルカリホスファターゼの発現は上昇しますが、オステオカルシンの発現は低下し、石灰化障害を来すことが報告されています。 そこで、我々はこの骨芽細胞成熟度障害が2型糖尿病の脆弱性に関連しているか否かを検討した。
2型糖尿病男性において、オステオカルシンとBAPの比率(オステオカルシン/BAP比)と骨脆弱性の指標として椎体骨折の存在との関連性を検討したところ、オステオカルシン/BAP比が高いほど椎体骨折リスクが低下している、すなわち骨芽細胞が成熟していれば骨折のリスクが低いという結果を得た。
このことから、2型糖尿病の骨脆弱性には骨芽細胞の成熟度障害が関連している可能性が示唆される。
肥満と高血糖の共存により骨折リスクが上昇する
では、どういった患者が骨芽細胞成熟度障害きたすのでしょう?
前述の通り高血糖状態はBAPの上昇、オステオカルシンの低下を来します。しかしながら、血糖状態の指標であるHbA1cのみでは骨折リスクとは相関しないと報告されており、実際我々の検討でもHbA1cのみでは骨折リスクとの有意な関連性は認められていません。
一方で、肥満は2型糖尿病の重要なリスク因子になりますが、骨にとっては保護的に働くことはよく知られています。肥満すると骨代謝回転の低下(骨形成かつ骨吸収の低下)がみられ、骨密度は上昇します。 このことは非糖尿病患者においては骨折リスクの減少に働くが、2型糖尿病患者においても肥満が骨に保護的に働いているのではないかと考えられます。
しかしながら、2型糖尿病患者の低骨代謝回転型の骨脆弱性に肥満が寄与している可能性も考えられます。
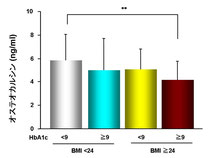
2型糖尿病男性を血糖状態と肥満度で4群に分け検討しました。
第1群;HbA1c 9%未満かつBMI(肥満度) 24未満
第2群;HbA1c 9%以上かつBMI(肥満度) 24未満
第3群;HbA1c 9%未満かつBMI(肥満度) 24以上
第4群;HbA1c 9%以上かつBMI(肥満度) 24以上(高血糖かつ肥満)
図に示すように第4群は第1群に比較して、分化した骨芽細胞から分泌されるオステオカルシンの血中濃度が有意に低下していることが示されました。
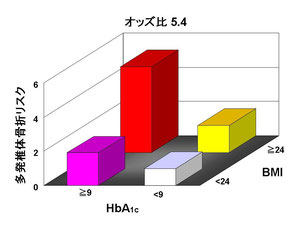
さらに、椎体骨折リスクとの関連を検討すると、 第4群は第1群に比較して 椎体骨折リスクが約3.1倍 多発椎体骨折リスクが約5.4倍 に増加していることが示されました。
骨折リスク・骨脆弱性の指標
前述のように2型糖尿病では骨密度の低下がないことから、骨粗鬆症の標準的検査である骨密度測定があまり役に立たないと考えられます。
従って、2型糖尿病患者の骨を評価するためには別の指標が必要であります。
しかしながら、未だ臨床的に応用可能な評価方法は確立していないのが現状であります。
血中IGF-I
以前より成長ホルモン/insulin like-growth factor-I (IGF-I)系のホルモンが糖尿病合併症に関連していることが報告されています。
視床下部より分泌される成長ホルモンは肝臓に働き、肝臓より血中へIGF-Iは分泌されます。IGF-Iは増殖因子として様々な臓器において重要な役割を担っており、骨においても最も重要なホルモンのひとつとして認識されています。例えば、骨芽細胞特異的IGF-I受容体欠損マウスにおいては、著明な骨量減少、石灰化症を来たし、また肝臓特異的IGF-Iノックアウトマウスにおいても明らかな骨量減少、骨成長の障害が認められます。
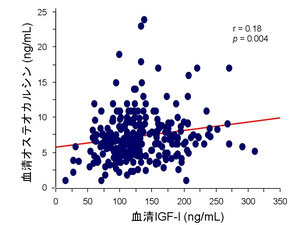
糖尿病のコントロール不良の状態では血中IGF-I値が低下することはよく知られており、また糖尿病微小血管障害(神経障害、網膜症、腎症)において成長ホルモン/IGF-Iの異常が関連することが報告されていることから、我々は糖尿病の骨代謝異常においても血中IGF-Iが関連しているのではないかと予測しました。 閉経後2型糖尿病女性における血清IGF-I値と骨代謝マーカーとの相関関係を検討しました。
骨形成マーカーであるオステオカルシンとIGF-Iは有意な正の相関を認めましたが(下図)、骨吸収マーカーである尿中NTXとは相関関係を認めませんでした。
糖尿病性骨症の病因として骨形成低下が重要であるといわれていますが、このことは糖尿病コントロール不良によるIGF-I低下が骨形成の低下と関連していることを示唆するデータと考えられました。
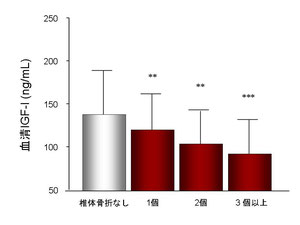
椎体骨折なし、1個あり、2個あり、3個以上有りに群分けし、血清IGF-I値を比較してみると、下図に示すように、椎体骨折の数が増えるほど血清IGF-I値が低下していることが明らかとなりました。
さらに、様々な交絡因子で補正したロジスティック回帰分析において、血清IGF-Iが1SD上昇すれば単椎体骨折のリスクは0.67倍に減少し、2個骨折は0.40倍、さらに3個以上骨折では0.27倍にリスクが低下することが明らかとなりました。
すなわち、閉経後2型糖尿病女性において、血清IGF-I値の低下は椎体骨折・多発椎体骨折のリスクになることが示唆された。
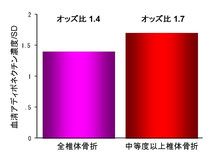
アディポネクチン
アディポネクチンは脂肪細胞から血中へ分泌されるホルモンであるが、肥満・内臓脂肪増加に比例して血中アディポネクチン濃度は低下します。
我々は培養細胞をもちいた基礎研究によりアディポネクチンが骨芽細胞分化を促進することを見出しています。以前より肥満と骨とは密接な関連性が認められていることから、血中アディポネクチンが骨密度、骨折リスクに関連している可能性を考え検討を行いました。
近年、アディポネクチンは骨芽細胞分化も促進しますが、骨芽細胞におけるRANKL発現の上昇を介して破骨細胞分化も促進し、骨代謝回転を高めることによって骨密度低下に働く可能性が報告されています。
従って、アディポネクチンは骨にとっては負に作用する可能性が考えられます。 しかしながら一方で、低骨代謝回転を呈する糖尿病患者においては、骨代謝回転を促進するアディポネクチンはむしろ善玉ホルモンとして働く可能性が考えられます。
我々は、高アディポネクチン血症が椎体骨折リスクの上昇と関連することを示す結果を得ていますが(上記)、一方でアディポネクチン高値の状態では血糖改善後に骨代謝回転が亢進すること、アディポネクチン高値であれば1年後の骨密度減少が抑制されることも見出しています。
従って、健常者においては高アディポネクチン血症は骨代謝回転亢進による骨密度低下、骨折リスク上昇に寄与すると考えられますが、低骨代謝回転を呈する2型糖尿病患者においてはむしろ保護的に働く可能性も考えられます。
ADMA、SDMA
Nitric oxide synthases (NOSs)は一酸化窒素(NO)を産生することにより動脈硬化形成を抑制することは知られています。一方で近年、NO/NOSの骨における役割についても報告がなされてきています。endothelial NOS (eNOS)は骨芽細胞においても発現しており、NOを産生することにより骨芽細胞の分化、石灰化を促進します。
内因性NOSs阻害物質であるasymmetric dimethylarginine (ADMA)はNOSs活性を阻害することによりNO産生を抑制することから悪玉物質として考えられています。 また、2型糖尿病ではNO合成が低下していることが知られていますが、一方で血中ADMA濃度も上昇していることも報告されています。
従って、ADMAが2型糖尿病患者の骨代謝異常に関連している可能性が考えられています。 そこで、我々は血中ADMAと構造的異性体であるsymmetric dimethylarginine (SDMA)を測定し、骨密度、骨代謝マーカー、椎体骨折との関連性を検討しました。
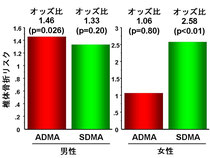
2型糖尿病男性においては、我々の予想通りに血中ADMA高値であれば、1SD上昇毎に約1.46倍の椎体骨折リスク上昇が認められました。SDMAにおいても同様の傾向は認めたものの、有意差は認められませんでした。 一方で、閉経後女性においては、我々の予想に反して血中SDMAが高値であれば椎体骨折リスクが約2.58倍に上昇することが認められました。
従って、男性では血中ADMAが、閉経後女性では血中SDMAが椎体骨折に関連していることが示唆され、椎体骨折リスクの評価項目として有用である可能性が考えられます。
しかしながら、なぜSDMAと骨折リスクが関係するのかについての機序は不明の状態であり、今後の検討が必要と考えています。
