残念ながら、まだまだこの事実を知らない医師、医療者も多いのが現状です(悲)。なので、私は時代背景と変遷を考慮し、糖尿病性運動器疾患(Diabetic Musculoskeletal Disease; DMD)と糖尿病性骨疾患(Diabetic Bone Disease; DBD)の概念を提唱し、その重要性を示す必要があると考えたため、ここでお示ししたいと思います。
以下は私がこれまで得た研究結果と私見をまとめたものです。これをベースに議論が発展し、今後の研究と臨床の発展に期待するとともに、みなさんの健康寿命に寄与できればと考えています。

エール君
以下からが金沢先生がこれまで得た研究結果と私見をまとめたものです。
超高齢社会でこれから取り組むべき課題とは?
人口の高齢化とともに糖尿病患者も高齢化しており、すでに約3分の2が65歳以上となっています。そう!高齢者糖尿病の管理はますます重要な課題になってきているのです。
高齢者糖尿病の管理では、高齢者特有の病態を意識した診療を行う必要があります。糖尿病は全身の臓器に様々な合併症をきたしますが、運動器も例外ではないのです。 糖尿病は骨、筋肉にも悪影響を及ぼし、運動器障害を惹起します。 働き盛りの世代は『長生きしたい』、老年期には『自立して活き活きと生きたい』というのは普遍的な願望だと思います。
運動器障害の問題はこの少子“超”高齢社会において医学的のみならず社会的、経済的にも重要な課題です。高齢者が自立した生活を送るために、私たちは運動器障害と向き合う必要があるのです。
古くは骨粗鬆症、サルコペニア(筋肉減少症)は加齢に伴う自然現象と静観されてきましたが、現在はさまざまな管理、治療法が確立されてきたこともあり、これからはこの加齢現象に立ち向かう時代となりました。
なぜDMDが重要なのか?
糖尿病は1型、2型ともに骨折リスクが高いことが明らかとなり、骨疾患は糖尿病の新たな合併症として認識されるに至りました。骨折は痛いだけでなく、その後の生活の質の低下1)と生命予後不良2)に強く影響します。一方、糖尿病はサルコペニアのリスク因子であるという報告も蓄積されてきています。筋肉は重要なインスリンの標的組織であることから糖代謝制御という観点からもサルコペニアは重要な疾患です。
サルコペニアも骨折と同様に生活の質の低下、生命予後不良3)を引き起こしてしまいます。 糖尿病患者が運動器障害を合併すると運動療法ができなくなり、さらには治療意欲の低下などから糖尿病の悪化を惹起することは容易に想像されますよね?一方、運動能力の低下はメカニカルストレス減少(運動による力学的負荷の低下)によりさらなる骨脆弱性が惹起されてしまいます。また、骨代謝異常(骨ホルモン分泌低下)は糖代謝にも影響する可能性があります4-8)。
運動不足は筋量低下に繋がり、筋ホルモン(マイオカイン)の分泌異常をともなうと糖代謝にも悪影響を及ぼすことにつながります。サルコペニアは転倒リスクを上昇し、転倒は骨折を引き起こします。一方、骨折は姿勢の変形、運動能低下、バランス異常により転倒リスクを上昇することから骨折とサルコペニアは臨床的にも相互に影響しあうことは理解できると思います9)。
つまり、糖尿病は運動器障害を惹起し、運動器障害は糖尿病を悪化するという双方向的な関連性があり、悪循環になり得る一方、上手に対処することができれば好循環にもなり得るのです。
すなわち、糖尿病性運動器疾患DMDは糖尿病の病態、糖尿病患者の人生に直結する最も重要な合併症であるといっても過言ではありません。
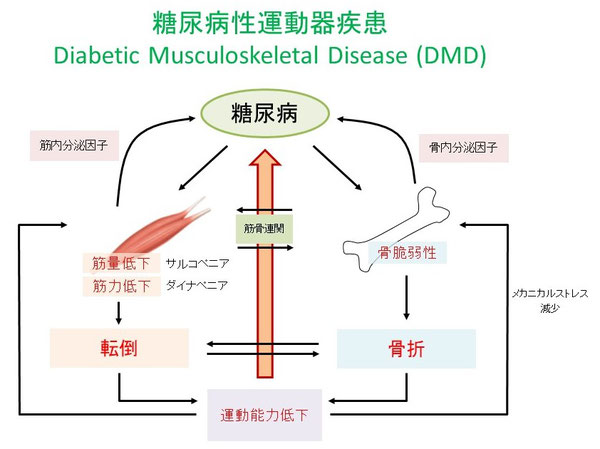
DMDに関与する因子は?
糖尿病は血糖値が高くなるだけではなく、その背景には様々な病態が存在します。インスリン抵抗性、酸化ストレス亢進はその代表ですが、それ以外にもアジア人に多いとされる内因性インスリン分泌能低下も重要な病因と考えられます。高血糖と酸化ストレス亢進は生体内で蛋白質のAGE (advanced glycation end product)化を惹起します。AGEsは組織局所で形成され蓄積することに加えて生理活性物質として細胞に直接作用します10)。
AGEsやインスリン作用は運動器障害の病態に関連することが明らかになってきています。
DBDの病態は?
糖尿病性骨疾患DBDは骨量の低下よりも骨質(材質特性、構造特性)の劣化が重要と考えられています。骨コラーゲンにAGEsが蓄積すると粘弾性が損なわれ、骨強度が低下します。骨では、リモデリングにより古い骨(質が劣化した骨)は常に新しい骨に生まれ変わるのですが、糖尿病では骨リモデリングが低下しているため、質の劣化した骨が排除されにくいことも骨内AGEsの蓄積を増長する要因と考えられます。
さらに骨リモデリング異常は骨微細構造の異常にも関わると考えられます11,12)。
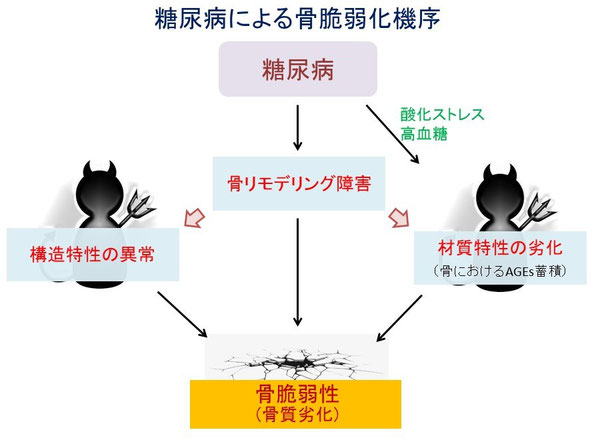
DBD発症のメカニズムは?
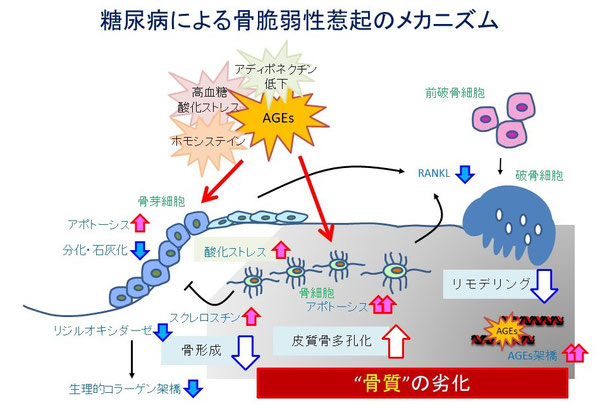
骨リモデリング異常にはAGEs、ホモシステインが関わると報告されています。骨芽細胞、骨細胞にはAGEsの受容体RAGEが発現しています。AGEsは直接的に骨芽細胞、骨細胞の機能低下、アポトーシスを惹起することにより骨形成低下と骨リモデリング異常を引き起こします13-16)。酸化ストレス誘導因子ホモシステインはインスリン作用低下によりその産生が増加します。
ホモシステインは骨芽細胞の酸化ストレスを誘導することにより、アポトーシス、生理的コラーゲン架橋形成の減少、細胞外AGEs蓄積を惹起します17)。 さらにホモシステインは骨細胞のアポトーシスを誘導することにより骨リモデリング異常を惹起します18,19)。
骨リモデリング異常、骨細胞アポトーシスは質の悪い骨の蓄積(材質特性の劣化)、骨微細構造の異常(構造特性の劣化)をきたすと考えられます。糖尿病における肥満は骨質の劣化から骨折リスクを上昇します20,21)。糖尿病、肥満患者では善玉ホルモンである血中アディポネクチンが低下しています。
アディポネクチンは骨芽細胞分化、骨リモデリング促進作用があるため22-25)、低アディポネクチンがDBDに関連している可能性があると考えられます。 前述のとおり糖尿病の病態は多彩なのですが、他にも重要な関連因子がある可能性は大いにあるため、さらなる研究の蓄積が重要です。
AGEsはサルコペニアの病態にも関連するか?
AGEsは骨のみならず筋組織にも形成、蓄積します。糖尿病患者における血中AGEsの上昇は筋量の低下と相関します26)。AGEsは筋肉に分化する筋芽細胞の分化を阻害し27)、アポトーシスを誘導することからAGEsがサルコペニアの増悪因子であることが示唆されます27,28)。 筋肉と骨は同じ場所に寄り添って存在するだけでなく、お互いの内分泌因子を介して相互に情報交換を行っています(筋骨連関)。
AGEsは筋細胞に作用してこの筋骨連関を障害することにより、筋肉を介して骨にも悪影響を及ぼす可能性があります27)。
したがって、DMDの治療標的としてAGEsはよい候補因子となると考えられます。
DMDにおける内因性インスリンの重要性
インスリンは骨と筋肉の両者にアナボリックに作用します。インスリンの運動器への局所作用は重要なので、内因性インスリン分泌能を維持することは糖尿病にとっても運動器にとっても重要だと考えられます。実際にインスリン分泌低下は筋量低下と相関します29)。インスリン抵抗性が筋量低下とも関連するといわれており、抵抗性であれ分泌低下であれインスリン作用が筋肉で低下することが重要な病態と考えられます。さらに膵臓から分泌され門脈を通過して直接肝臓に注ぎ込まれる高濃度のインスリンは肝臓に作用し、インスリン様成長因子1(insulin-like growth factor-I: IGF-I)の産生を促進します。
IGF-Iはインスリンよりも強く骨、筋肉にアナボリックに働くホルモンであり、IGF-Iの低下は骨折リスク30-32)、サルコペニアのリスク26)に関連します。
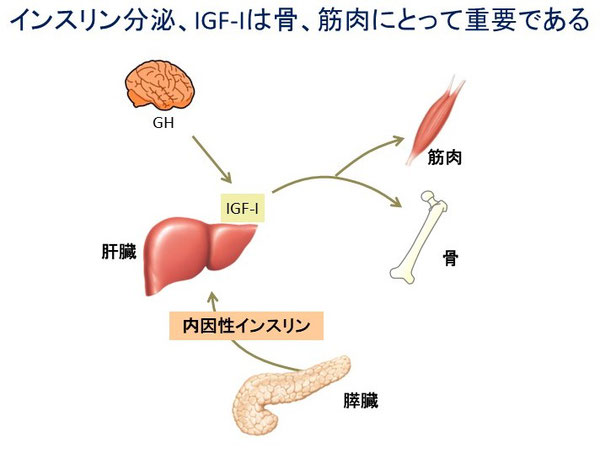
1型糖尿病ではインスリン注射をして末梢血インスリンを補給しても骨折リスクは著明に高いことからもインスリンの局所への影響だけでなく、内因性インスリンの重要性は明らかです。内因性インスリン分泌をいかに保つかは糖尿病治療に重要ですが、DMDにとっても必須だと考えられます。 この観点はDMDを意識した糖尿病治療薬の選択にも通じます。
内因性インスリン分泌に保護的に作用する薬剤や、上手にインスリン分泌を促進する薬剤はDMDにとって良い可能性があります。インスリンは骨にとってアナボリック因子である一方、臨床ではインスリン注射を行っている患者では骨折リスクが高いという一見の矛盾した報告があります32)。一般的にインスリン注射を行う患者では罹病期間が長い、合併症も多い、血糖コントロールが不良である、低血糖リスクなどの骨折リスク因子が重責していることが要因と考えられています。
それに加えて、インスリン注射が必要な患者では内因性インスリン分泌が低下していることも骨折リスクに関わる重要な要素と考えられます。
糖尿病治療はDMDを改善するか?
DMD/DBDは糖尿病に伴う続発性疾患です。HbA1cが高いほど骨折リスクが高いことは明らかであり、実際に血糖コントロールを行うと骨リモデリングが改善しますので23,34)、糖尿病治療によりDMD/DBDが改善することは期待できます。骨リモデリングが改善すれば質の悪い骨もそのうち新しい強い骨へと生まれ変わります。
したがって、十分な血糖管理を行うことはDMD/DBDを予防・改善しうると考えられます。
一方、低血糖が骨折リスクを上昇するとの報告がありますので、単に血糖改善を目指すだけではなく、どのように血糖管理を行っていくかも重要です。
しかしながら、実臨床で長期的に血糖管理を行うことが難しいケースは多く存在します。 特に高齢者では低血糖を避けるために目標HbA1cを高めに設定せざるを得ないことも多いのですが、そのようなケースでは無理に血糖管理を行うことに執着せず骨粗鬆症治療薬によりDBDの治療を行う必要があります。
誤解のないように付け加えておきたいと思いますが、長期的な糖尿病管理が行えたとしても加齢、閉経の影響は避けられないので必ずしも骨粗鬆症が起こらないという訳ではありません。
あくまで“糖尿病による”骨折リスクを下げるということです。
一方、血糖管理のみでサルコペニアが改善するというエビデンスは今のところありません。サルコペニアに対する薬物治療はないことから食事療法、運動療法が現時点では主な対処法となります。DMDという観点からはビタミンンD充足、加重運動は筋のみならず骨強度改善にも良い影響があり、ひいては糖尿病の改善にもつながることから推奨されます。
ビタミンDは筋細胞の分化を促進するのみならずAGEsの悪影響を阻害し、筋骨連関を強固にします27)。
DBDの診断方法は?
骨粗鬆症患者には原発性骨粗鬆症に糖尿病を単に合併している患者、糖尿病による骨脆弱性を伴うDBD患者が存在します。しかしながら、骨脆弱性を加齢、閉経による原発性骨粗鬆症によるものか糖尿病によるものかを明確に区別することはできません。
したがって、臨床上は糖尿病があれば骨質劣化が存在することを念頭に、糖尿病の管理に加えて原発性骨粗鬆症の治療開始基準を参考に積極的治療介入を行うこととなります。
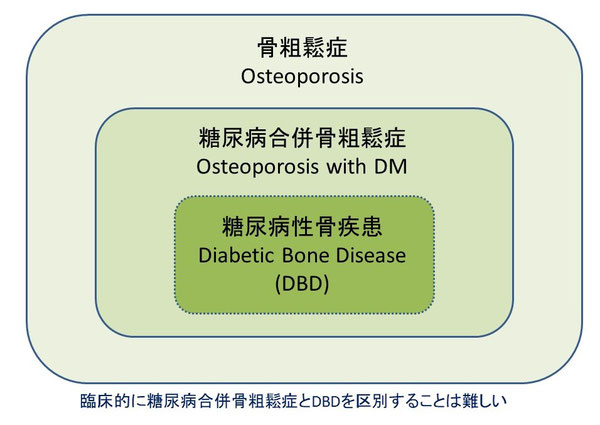
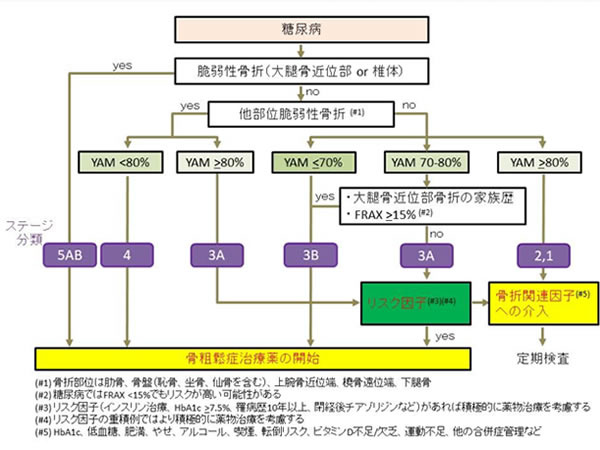
DBDステージ分類の提案
DBDの治療方針を考えるうえで、その重症度を考慮することは重要です。以下にステージ分類について提案したいと思います。大腿骨近位部骨折、多発椎体骨折、グレード2以上をともなう椎体骨折は明らかにADL/QOL低下、生命予後不良につながるため治療介入は必須でありステージ5Bとなります。既存骨折の存在はステージ5Bに進行する重要なリスク因子であるため、既存椎体骨折(単、グレード1)をステージ5A、他の部位の既存骨折のある骨量減少(YAM 80未満)をステージ4としました。骨折の既往がなくても骨密度がYAM 70%未満であれば治療の必要がありステージ3Bとなります。
DBDではYAM 70~80%であっても骨折リスクが高く、リスク因子(インスリン治療中、罹病歴10年以上、閉経後女性チアゾリジン使用33,35))がある場合をステージ3Bとしました。基本的に、骨粗鬆症治療薬の適応がある状態をステージ3B以上となります。
他の部位の既存骨折はあるがYAM 80%以上、既存骨折はないがYAM 70~80%でもDBDでは骨折リスクは高いと考えられます。しかし、骨粗鬆症治療薬の適応の意見が分かれるところでありステージ3Aとしました。既存骨折も骨量低下もない(YAM >80%)がリスク因子のあるものをステージ2、ないものをステージ1としました。
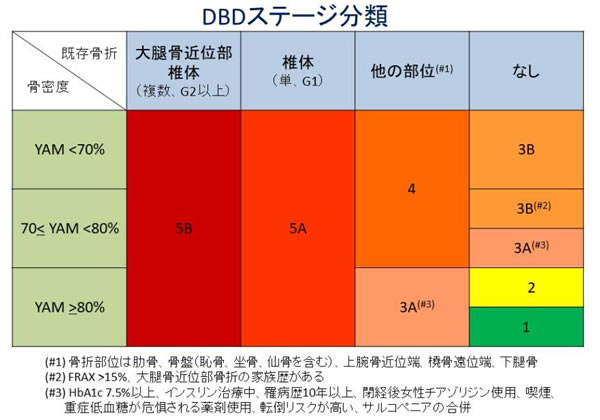
DBDの骨折リスク評価ツールの提案
骨粗鬆症診断のgold standardである骨密度測定はDBD診療においても重要です。糖尿病では非糖尿病と比較して、同じ骨密度であっても骨折リスクが高いことが示されています。骨質劣化が背景にあるからです。過去の報告から糖尿病患者では骨密度Tスコアの値から0.5 SD差し引いて考慮すべきとの意見があります。つまり、通常は骨密度Tスコア-2.5 SDで骨粗鬆症と診断しますが、糖尿病では-2.0SDが妥当ではないかという意見です。
一方、非糖尿病者に比較して骨密度の骨折予測因子としての感度が悪いことが報告されています。したがって、DBDは骨密度のみで評価すると骨折リスクを過小評価する可能性があります。
骨密度-2.5 SD未満では骨折リスクが超高い、-2.0 SD未満では骨折リスクが高いと考えてよいですが、-2.0 SD以上であれば“大丈夫”とは言えないということになります。この点がDBD診療の難しい点ですね。
そのためいくつかの指標を組み合わせることによって骨折リスクを評価する必要があると考えています。私たちは以前に骨密度と血清IGF-Iを組み合わせて評価することにより骨折リスクを評価することを提案しました36)。しかしながらこの評価は保険適用の問題など実臨床で応用するにはいくつかの困難があります。
そこで骨折リスクに関連する因子を探索し、その因子の重積をスコア化することにより骨折リスクを評価するツールを検討しました。DBD診療の拡充には特殊な施設ではなくても簡単に評価できる指標を用いることを念頭にスコアリングツールの開発を行いました。
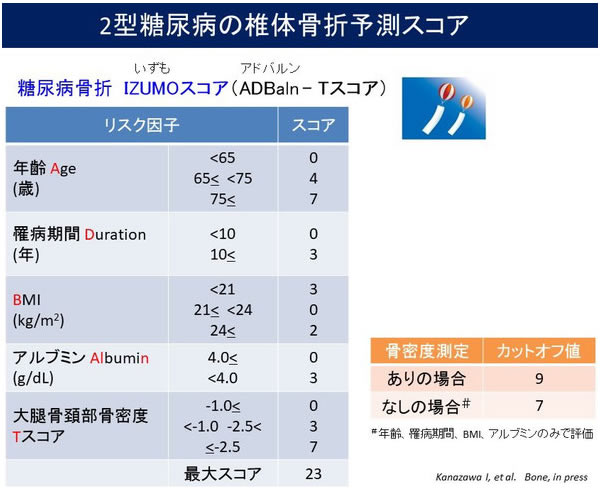
糖尿病骨折IZUMOスコア(IZUMO ADBaln - Tスコア)
私たちは骨密度に加えて他の骨折リスク関連因子を用いて、2型糖尿病の骨折リスクを評価できるスコアリングツールの開発を試みました37)。2型糖尿病患者808人を対象に椎体骨折に関連する指標を探索したところ、年齢、糖尿病罹病期間、BMI、血清アルブミン、大腿骨頸部骨密度が抽出されました。その後、ROC解析、ロジスティック回帰分析により各指標をスコア化し、椎体骨折の有無を判定できるカットオフ値を算出しました。各指標をカテゴリー化し、重みづけを行った後、以下のようにスコア化を行いました。
1)年齢(65歳未満;0点、65歳以上75歳未満;4点、75歳以上;7点)
2)罹病期間(10年未満;0点、10年以上;3点)
3)BMI(21未満;3点、21以上24未満;0点、24以上;2点)
4)血清アルブミン(4未満;3点、4以上;0点)
5)大腿骨頸部骨密度Tスコア(-2.5以下;7点、-2.5より大きく-1.0未満;3点、-1.0以上;0点)
ROC解析により、椎体骨折に対する合計スコアのカットオフ値は8.5(感度74.7%)でした。さらに、一般病院では骨密度測定ができないことも想定し、骨密度を除いた使用を用いて検討を行ったところカットオフ値は6.5(感度70.4%)でした。
様々な背景因子で補正したロジスティック回帰分析により、スコア9点以上(骨密度を除いた場合のスコア7点以上)が有意に椎体骨折リスクと関連することが示されました。
したがって、2型糖尿病患者において年齢、罹病期間、BMI、血清アルブミン、大腿骨頸部骨密度(オプショナル)を評価し、スコアリングを行うことにより椎体骨折リスクを評価できる可能性が示唆されました。
DBDに対する骨粗鬆症治療薬をいつから始めるか?
糖尿病の合併の有無に関わらず、骨粗鬆症の予防と治療ガイドライン2015年版の治療開始基準に当てはまれば骨粗鬆症治療薬の開始を行う必要があります。すなわち、DBDであっても二次予防は重要であり、特に大腿骨近位部骨折、椎体骨折がある場合(ステージ5AB)は骨密度に関わらず治療が必要です。他の部位の脆弱性骨折に加えYAM <80%がある場合(ステージ4)、YAM <70%の場合(ステージ3B)、YAM 70-80%に加え家族歴、FRAX15%以上がある場合(ステージ3B)は治療介入の適応となります。この点は原発性骨粗鬆症ガイドライン2015年に準じています。
注意すべきは糖尿病を合併している場合には骨質劣化が背景にあることを念頭に十分な治療介入が必要ということを念頭に置く必要があります。
DBDでは骨質劣化が存在するということを加味するとYAM 70-80%(ステージ3A)でも治療介入が必要な可能性があります。特にリスク因子(インスリン治療、罹病歴10年、HbA1c 7.5%以上、閉経後女性におけるチアゾリジン使用など)が存在する場合には積極的に治療介入を考慮すべきであり、リスク因子が重責している場合には“さらに積極的に”治療介入が必要と考えられます。評価時に骨粗鬆症治療薬の適応にない場合(ステージ1、2)、治療適応が考慮された場合でも治療開始ができないケース(一部のステージ3A)は現実に存在します。
その場合には介入可能なリスク因子には対応しつつ継続的な経過観察が必要となります。 糖尿病では非糖尿病よりも骨密度低下が速いという報告もあり、前値にもよりますが2年に1回程度は骨密度測定を行っていただきたいと思います。また、経過観察中でも無痛性椎体骨折が発生する可能性がありますのでX線や身長の低下などの定期スクリーニングが推奨されます。
(以下は私が提案する治療介入フローチャート)
最後に
最後まで読んでいただき、誠にありがとうございました。
誠に勝手ながらDMD、DBDという概念について提唱させていただき、私見を述べさせていただきました。この領域はまだエビデンスが足りないことも多く、私たちも研究を継続中です。したがって、新たな研究報告や気づいた点があれば随時修正を加えていく予定です。
皆さん(私も含めて)が活き活きとした元気な人生を送れるように、微力ながら努力を継続していきたいと思っています。
2018年10月、出雲の地から
2021年8月改訂
引用文献
Kanazawa I, et al. Osteoporosis and vertebral fracture are associated with deterioration of activities of daily living and quality of life in patients with type 2 diabetes mellitus. J Bone Miner Metab, Epub ahead of print
Miyake H, Kanazawa I, et al. Association of bone mineral density, bone turnover markers, and vertebral fractures with all-cause mortality in type 2 diabetes mellitus. Calcif Tissue Int 120(1): 1-13, 2018
Miyake H, Kanazawa I, et al. Low skeletal muscle mass is associated with the risk of all-cause mortality in patients with type 2 diabetes mellitus. Submitted
Kanazawa I, et al. Serum osteocalcin level is associated with glucose metabolism and atherosclerosis parameters in type 2 diabetes mellitus. J Clin Endocrinol Metab 94(1): 45-9, 2009
Kanazawa I, et al. Serum undercarboxylated osteocalcin was inversely associated with plasma glucose level and fat mass in type 2 diabetes mellitus. Osteoporos Int 22 (1): 187-94, 2011
Kanazawa I, e al. Serum osteocalcin level is positively associated with insulin sensitivity and secretion in patients with type 2 diabetes. Bone 48(4): 720-5, 2011
Kanazawa I. Osteocalcin as a hormone regulating glucose metabolism. World J Diabetes 6(18): 1345-54, 2015
Kanazawa I, et al. The association between osteocalcin and chronic inflammation in patients with type 2 diabetes mellitus. Calcified Tissue International and Musculoskeletal Research, Epub ahead of print
Yokomoto-Umakoshi M, Kanazawa I, et al. Association between the risk of falls and osteoporotic fractures in patients with type 2 diabetes mellitus. Endocr J 64(7): 727-34, 2017
Kanazawa I, et al. The mechanism of bone fragility in diabetes mellitus. Glycative Stress Research 4(4): 266-74, 2017
Kanazawa I. Interaction between bone and glucose metabolism. Endocr J 64(11): 1043-53, 2017
Kanazawa I, et al. Diabetes mellitus-induced bone fragility. Intern Med 57(19): 2773-85, 2018
Tanaka KI, Kanazawa I, et al. Advanced glycation end products suppress osteoblastic differentiation of stromal cells by activating endoplasmic reticulum stress. Biochem Biophys Res Commun 438(3): 436-7, 2013
Notsu M, Kanazawa I, et al. Advanced glycation end product 3 (AGE3) suppresses the mineralization of mouse stromal ST2 cells and human mesenchymal stem cells by increasing TGF-b expression and secretion. Endocrinology 155(7): 2402-10, 2014
Tanaka KI, Kanazawa I, et al. Effects of high glucose and advanced glycation end products on the expressions of sclerostin and RANKL as well as apoptosis in osteocyte-like MLO-Y4-A2 cells. Biochem Biophys Res Commun 461(2): 193-9, 2015
Notsu M, Kanazawa I, et al. Advanced glycation end product 3 (AGE3) increases apoptosis and the expression of sclerostin by stimulating TGF-b expression and secretion in osteocyte-like MLO-Y4-A2 cells. Calcif Tissue Int 100(4): 402-11, 2017
Kanazawa I, et al. Bazedoxifene ameliorates homocysteine-induced apoptosis and accumulation of advanced glycation end products by reducing oxidative stress in MC3T3-E1 cells. Calcif Tissue Int 100: 286-97, 2017
Takeno A, Kanazawa I, et al. Activation of AMP-activated protein kinase protects against homocysteine-induced apoptosis of osteocytic MLO-Y4 cells by regulating the expression of NADPH oxidase 1 (Nox1) and Nox2. Bone 77: 135-41, 2015
Takeno A, Kanazawa I, et al. Simvastatin rescues homocysteine-induced apoptosis of osteocytic MLO-Y4 cells by decreasing the expressions of NADPH oxidase 1 and 2. Endocr J 63(4): 389-95, 2016
Kanazawa I, et al. Combination of obesity with hyperglycemia is a risk factor for the presence of vertebral fractures in type 2 diabetic men. Calcif Tissue Int 83(5): 324-31, 2008
Kanazawa I, et al. Overweight and underweight are risk factors for vertebral fractures in patients with type 2 diabetes mellitus. J Bone Miner Metab, Epub ahead of print
Kanazawa I, et al. Adiponectin and AMP kinase activator stimulate proliferation, differentiation, and mineralization of osteoblastic MC3T3-E1 cells. BMC Cell Biol 29; 8: 51, 2007
Kanazawa I, et al. Adiponectin is associated with changes in bone markers during glycemic control in type 2 diabetes mellitus. J Clin Endocrinol Metab 94(8): 3031-7, 2009
Kanazawa I, et al. Relationships between serum adiponectin levels versus bone mineral density, bone metabolic markers, and vertebral fractures in type 2 diabetes mellitus. Eur J Endocrinol 160(2): 265-73, 2009
Kanazawa I, et al. Baseline serum total adiponectin level is positively associated with changes in bone mineral density after 1 year treatment of type 2 diabetes. Metabolism 59(9): 1252-6, 2010
Tanaka KI, Kanazawa I, et al. Elevated serum pentosidine and decreased serum IGF-I levels are associated with loss of muscle mass in postmenopausal women with type 2 diabetes mellitus. Exp Clin Endocrinol Diabetes 124(3): 163-6, 2016
Tanaka KI, Kanazawa I, et al. Advanced glycation end products suppress osteoblastic differentiation of stromal cells by activating endoplasmic reticulum stress. Biochem Biophys Res Commun 438(3): 436-7, 2013
Adachi N, Kanazawa I, et al. Insulin-like growth factor-I protects against the detrimental effects of advanced glycation end products and high glucose in myoblastic C2C12 cells. Calcif Tissue Int 105(1): 89-96, 2019
Tanaka KI, Kanazawa I, et al. Reduction in Endogenous Insulin Secretion Is a Risk Factor of Sarcopenia in Men with Type 2 Diabetes Mellitus. Calcif Tissue Int 97(4): 385-90, 2015
Kanazawa I, et al. Serum insulin-like growth factor-I level is associated with the presence of vertebral fractures in postmenopausal women with type 2 diabetes mellitus. Osteoporos Int 18(12): 1675-81, 2007
Kanazawa I, et al. Serum Insulin-like growth factor-I is a maker for assessing the severity of vertebral fractures in postmenopausal women with type 2 diabetes mellitus. Osteoporos Int 22(4): 1191-8, 2011
Miyake H, Kanazawa I, et al. Decreased serum insulin-like growth factor-I is a risk factor for non-vertebral fractures in diabetic postmenopausal women. Intern Med 56(3): 269-73, 2017
Kanazawa I, et al. Relationships between treatments with insulin and oral hypoglycemic agents versus the presence of vertebral fractures in type 2 diabetes mellitus. J Bone Miner Metab 28(5): 554-60, 2010
Kanazawa I, et al. Relationship between bone biochemical markers versus glucose/lipid metabolism and atherosclerosis; a longitudinal study in type 2 diabetes mellitus. Diabetes Res Clin Pract 92(3): 393-9, 2011
Kanazawa I, et al. Baseline atherosclerosis parameter could assess the risk of bone loss during pioglitazone treatment in type 2 diabetes mellitus. Osteoporos Int 21(12): 2013-8, 2010
Kanazawa I, et al. Assessment using serum insulin-like growth factor-I and bone mineral density is useful for detecting prevalent vertebral fractures in patients with type 2 diabetes mellitus. Osteoporos Int 29(11): 2527-35, 2018
Kanazawa I, et al. A scoring assessment tool for the risk of vertebral fractures in patients with
type 2 diabetes mellitus. Bone 122: 38-44, 2019
